Per combustione di ![]() di un composto organico che contiene
di un composto organico che contiene
![]() si ottengono
si ottengono ![]() di
di ![]() e
e ![]() di
di
![]() . La
. La ![]() liberata da
liberata da ![]() dello stesso composto ed
assorbita su
dello stesso composto ed
assorbita su ![]() , richiede per la titolazione
, richiede per la titolazione ![]() di
di
![]() . Il peso molecolare e' stato ottenuto sperimentalmente
nel seguente modo: il volume di
. Il peso molecolare e' stato ottenuto sperimentalmente
nel seguente modo: il volume di ![]() della sostanza allo stato
gassoso e' di
della sostanza allo stato
gassoso e' di ![]() alla temperatura di
alla temperatura di ![]() ed alla
pressione di
ed alla
pressione di ![]() . Determinare la formula empirica e quella
molecolare.
. Determinare la formula empirica e quella
molecolare.
SVOLGIMENTO
Dati:
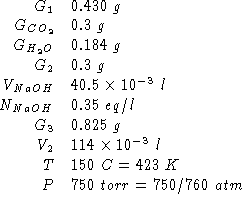
Altri simboli:

![]()
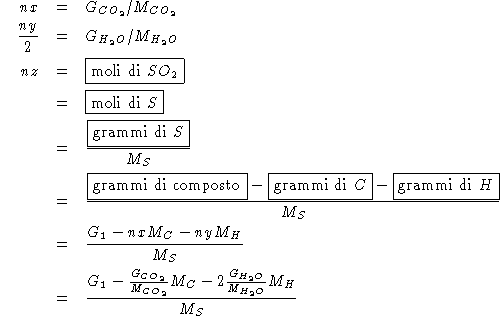
Da quanto sopra si ricava:
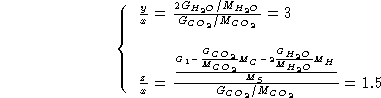
Quindi la formula minima e':
![]()
Per la formula molecolare:
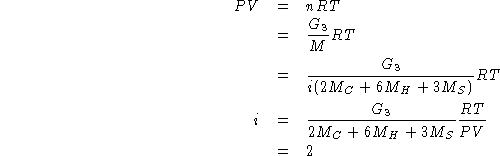
Quindi la formula molecolare e':
![]()
Si hanno ![]() di una soluzione
di una soluzione ![]() di
di ![]() .
.
Determinare :
![]() \
\
SVOLGIMENTO
Dati:
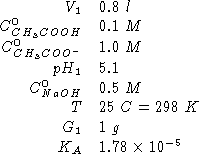
Altri simboli:

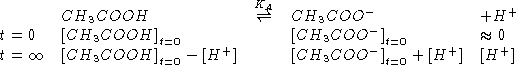
![]()
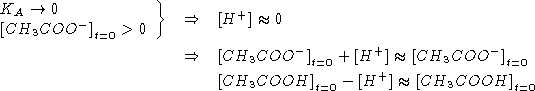
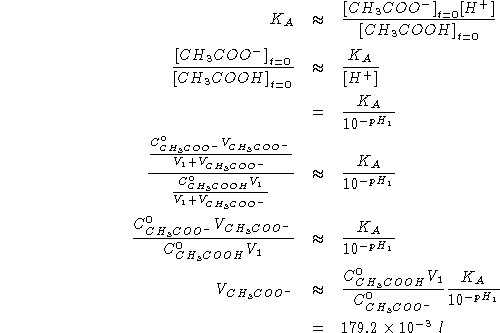
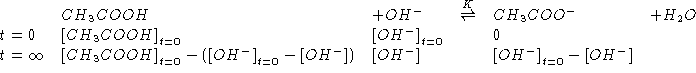
![]()
NOTA:
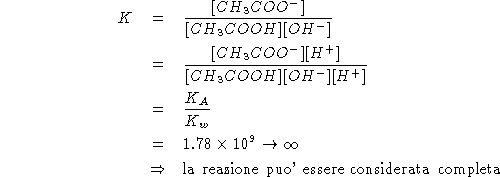
Inoltre: all'equivalenza vale:
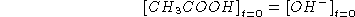
Da quanto sopra segue:
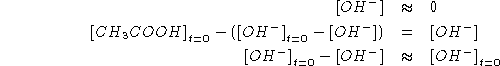
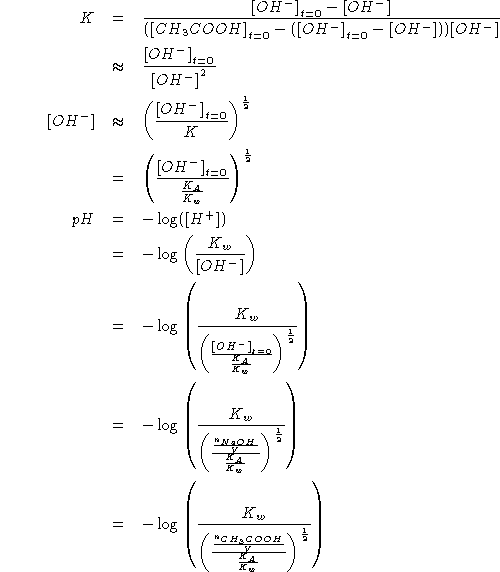
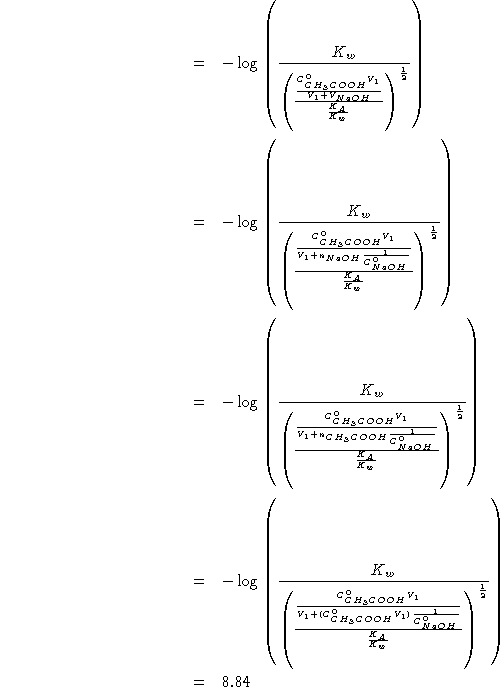
![]()
Per trovare
![]() :
:
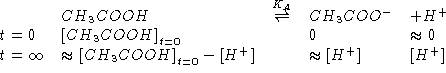
![]()
![]()
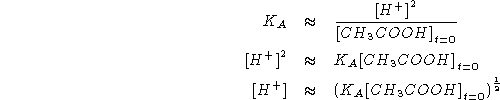
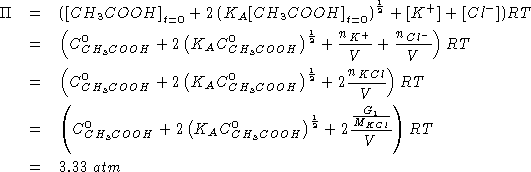
Scrivere e bilanciare le seguenti reazioni di ossidoriduzione:
SVOLGIMENTO
La reazione non bilanciata e':
![]()
NOTA: nelsia l'arsenico che lo zolfo vengono ossidati. La cosa piu' conveniente e' quella di scrivere un'unica semireazione di ossidazione.
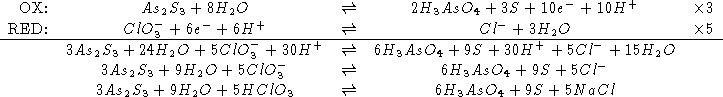
La reazione non bilanciata e':
![]()
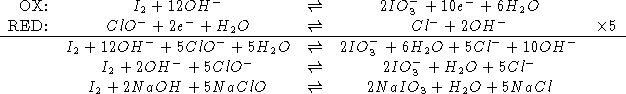
Una soluzione ![]() di un sale di nickel viene trattata con un
eccesso di cobalto metallico. Sapendo che il potenziale standard di
riduzione della coppia
di un sale di nickel viene trattata con un
eccesso di cobalto metallico. Sapendo che il potenziale standard di
riduzione della coppia ![]() e' di
e' di ![]() e che quello
della coppia
e che quello
della coppia ![]() e' di
e' di ![]() , calcolare la
concentrazione degli ioni
, calcolare la
concentrazione degli ioni ![]() all'equilibrio:
all'equilibrio:
![]()
SVOLGIMENTO
Dati:
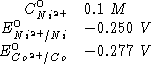
Altri simboli:
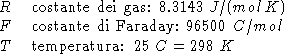
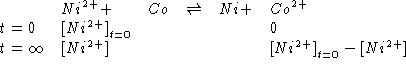
![]()
All'equilibrio deve valere:
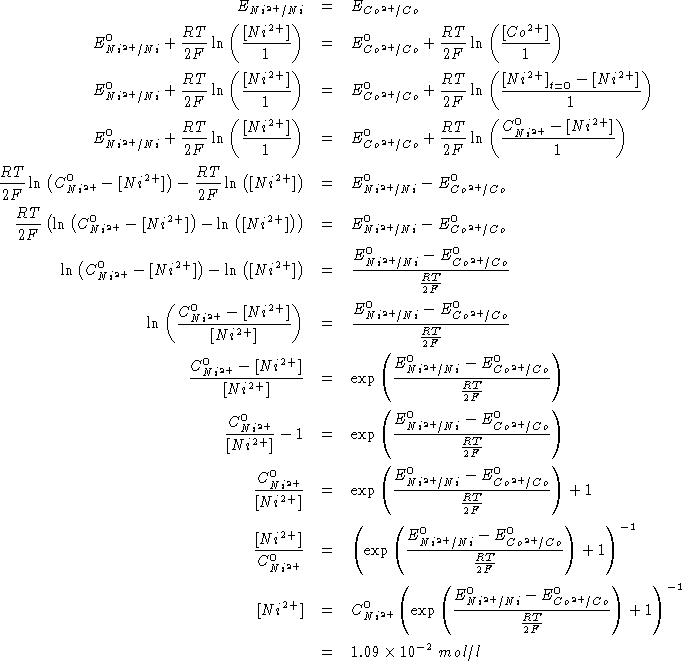
Per la reazione:
![]()
si ha equilibrio ad una data temperatura quando, partendo da una mole
di azoto e tre moli di idrogeno la frazione molare di ammoniaca e'
0.09 ad una pressione totale di ![]() . Calcolare la
. Calcolare la ![]() \
della reazione.
\
della reazione.
SVOLGIMENTO
Dati:
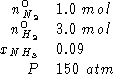
Altri simboli:

Per trovare ![]() e
e ![]() :
:
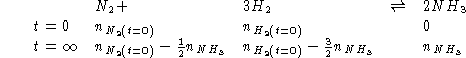
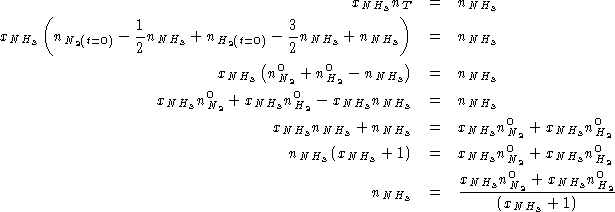
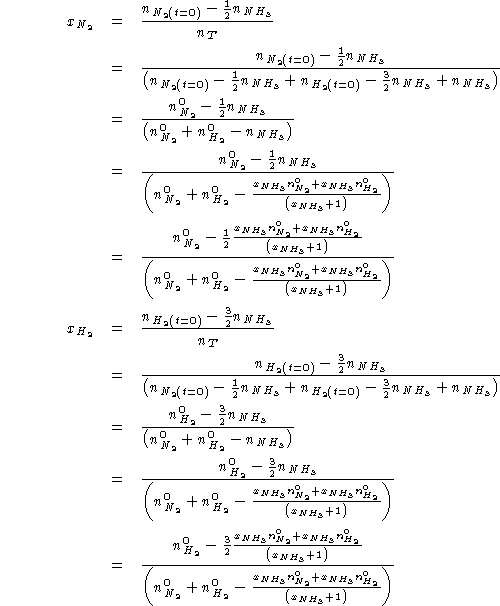
Sostituendo in (1):
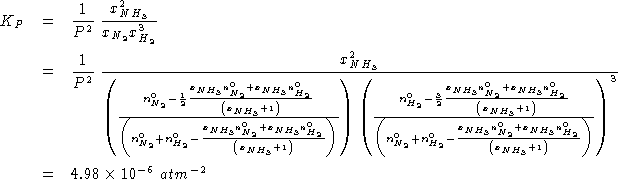
%